С.П. Яцык, А.Г. Буркин, С.М. Шарков, Б.К. Шамов
Научный центр здоровья детей РАМН, Москва
Гипоспадия является одним из наиболее распространенных врожденных пороков формирования уретры у мальчиков. В статье рассматриваются основные этапы внутриутробного формирования наружных половых органов у мальчиков и возможные аномалии, приводящие к развитию гипоспадии. Приводятся современные классификации данной болезни и подходы к ее лечению. Описан собственный опыт оперативного лечения, послеоперационного ведения и профилактики рубцовых осложнений после оперативного лечения гипоспадии. Ключевые слова: гипоспадия, хирургическое лечение, рубцы, меатостеноз.
Впервые гипоспадия как заболевание было описано Галеном. В современной литературе гипоспадия определяется как врожденное недоразвитие мочеиспускательного канала, при котором его наружное отверстие открывается в области венечной борозды, на нижней поверхности полового члена, в мошонке или промежности.
Формирование наружных половых органов у эмбриона мужского пола начинается на 5-й нед. развития с формирования полового бугорка в каудальном отделе. К 7-й нед. развития формируются половые складки, а последующее замыкание уретрального желоба в направлении от центра к периферии приводит к формированию уретры. Дистальный отдел мочеиспускательного канала окончательно формируется к 10-11-й нед внутриутробного развития путем воронкообразного втя-жения на головке полового члена навстречу уретральной трубке. Данный процесс завершается к 20-й нед. гестации.
Кавернозное тело уретры развивается по той же схеме, однако «отстает» в своем развитии примерно на 1/3 длины от уретральной трубки. Его окончательное формирование происходит на фоне пубертатного увеличения уровня секреции андрогенов.
Подобный путь формирования наружных половых органов объясняет механизм формирования гипоспадии: чем раньше плод подвергается воздействию неблагоприятных факторов, тем проксимальней располагается отверстие порочно сформированного мочеиспускательного канала.
Вопрос этиологии гипоспадии до настоящего времени является не до конца изученным, однако исследования указывают на полиэтиологичность заболевания. Среди факторов, вызывающих развитие гипоспадии, следует отметить неблагоприятную экологическую ситуацию, воздействие повышенного радиационного фона в период, предшествующий зачатию. Некоторые авторы важную роль в развитии порока отводят нарушению гормонального фона (эстрогениза-ция материнского организма в период беременности) [3].
О возможности генетической детерминации развития гипоспадии говорит тот факт, что порок входит в симпатокомплекс ряда генетических синдромов и болезней (синдром Опица-Фриаса, синдром телеканта-гипоспадии, синдром Смита-Лемли и др.). Кроме того, описаны случаи наследственной гипоспадии. Считается, что риск возникновения гипоспадии возрастает в 30 раз, если в семье уже имеется больной ребенок, и в 5 раз, если гипоспадия выявлена у отца. Частота возникновения гипоспадии на сегодняшний день составляет 1 случай на 200-300 мальчиков.
Вопросы классификации гипоспадии на сегодняшний день являются ключевыми, т. к. их решение позволяет обеспечить преемственность в лечении и стандартизировать статистические данные, касающиеся данной патологии.
Таблица. Классификация гипоспадии (П.П. Продеус, О.В. Староверов, 2003)
В основу всех существующих на сегодняшний день классификаций положена степень дистопии меатуса и наличие искривления полового члена. В России наиболее часто употребляются классификации Н. Е. Савченко (1974) и В. Н. Русакова (1991). Однако, на наш взгляд, наиболее удобной для постановки клинического диагноза и наиболее эмбриологически обоснованной является классификация П. П. Продеуса и О. В. Староверова (2003).
По этой классификации выделяют переднюю, среднюю и заднюю гипоспадии с расположением меатуса в околовенечной области, на стволе полового члена или в области мошонки и промежности, соответственно. Принимая во внимание нормальное строение мочеиспускательного канала при «гипоспадии без гипоспадии», последняя была включена авторами в группу врожденных искривлений полового члена. Более подробно классификация порока представлена в табл.
Диагностика гипоспадии не представляет трудностей. Вместе с тем она требует тщательного осмотра пациента. Данный порок, являясь одним из проявлений интерсексуальности, может быть связан с проблемами детерминации пола. В настоящее время проблема определения пола у больных с гипоспадией остро не стоит для урологов, что обусловлено возросшим профессионализмом работников родильных домов, развитием медикогенетической службы и методик определения пола, следовательно, ранним выявлением больных с нарушением половой дифференцировки. Однако сомнения в правильном определении пола у мальчиков могут возникнуть при наличии у больного тяжелой формы порока, сочетающейся с двусторонним крипторхизмом, микропенисом, расщеплением мошонки, широким входом в уретру. В подобных случаях приходится дифференцировать гипоспадию от ложного женского гермафродитизма.
Целью оперативного лечения гипоспадии является восстановление нормального мочеиспускания, выпрямление полового члена и косметическая коррекция порока. Под нормальным подразумевается мочеиспускание в положении стоя, одной не разбрызгивающейся струей, направленной вдоль оси полового члена. Для достижения этой задачи необходимо выбрать операцию, позволяющую создать уретру возрастного диаметра без сужений и расширений, лишенную волосяного покрова, с меатусом, расположенным на верхушке головки.
В настоящее время известно более 300 различных методик для коррекции гипоспадии. Среди детских урологов нет единого, всеми признанного подхода к оперативному лечению порока. В нашей клинике наиболее часто используют операции Onlay, Onlay-Tube-Onlay, Snodgrass при проксимальных формах порока и операции MAGPI и Mathiu при околовенечных формах гипоспадии.
Несмотря на достаточно большой опыт и значительное число методик хирургической коррекции порока, на сегодняшний день не удается до конца избежать развития осложнений.
За последние 12 мес в отделении уроандрологии НЦЗД РАМН наблюдалось 19 детей, ранее прооперированных по поводу гипоспадии (18 детей возрасте от 3 до 7 лет и один ребенок в возрасте 15 лет). У 18 детей послеоперационный период был осложнен развитием меатостеноза, сочетавшегося у 3 детей с дивертикулом уретры, а у 15 — со свищами уретры, у ребенка 15 лет основной жалобой был неудовлетворительный косметический эффект выполненного оперативного вмешательства.
Всем 19 пациентам были проведены повторные операции: меатотомия, сочетавшаяся в 3 случаях с иссечением дивертикула уретры по методике Horton-Devine и в 15 случаях — с пластическим закрытием свища уретры по методике Borchers, 1 пациенту (15 лет) было произведено иссечение рубца на вентральной поверхности полового члена с пластическим закрытием дефекта встречными лоскутами. Во время всех операций и в послеоперационном периоде деривация мочи осуществлялась по пластиковому уретральному катетеру возрастного диаметра, введенному в мочевой пузырь на 4-5 см глубже шейки. Катетер фиксировался лигатурой, проведенной через тыльную сторону головки полового члена по срединной линии. После выполнения оперативного вмешательства на половой член накладывалась стерильная компрессионная повязка, что снижало риск развития гематом и выраженного отека полового члена. При гладком течении послеоперационного периода компрессионная повязка удалялась не ранее 7-х сут.
Мы считаем целесообразным назначение антибактериальных препаратов в минимальных дозировках всем пациентам с целью профилактики воспалительных осложнений. Дети, особенно младшего возраста, наиболее тяжело переносят первые 2-3 сут после операции, что связано, главным образом, с болями в области послеоперационной раны, поэтому важным моментом является адекватное обезболивание. Для купирования болевого синдрома мы использовали нестероидные противовоспалительные средства. У детей старшего возраста к обезболивающим добавлялись седативные препараты для предотвращения возникновения нежелательных эрекций.
Также очень важно следить за регулярным опорожнением кишечника у ребенка; при резком увеличении внутрибрюшного давления при потугах больной может непроизвольно мочиться, в т. ч. и без катетера, что увеличивает риск развития инфицирования послеоперационной раны.
На 7-е сутки удалялась компрессионная повязка. Уретральный катетер удалялся на 8-9 сутки. При «открытом» ведении линия швов обрабатывалась 5% раствором перманганата калия. На 5-6 сутки течения раневого процесса начинается коллагенизация раны, т. е. формирование рубцовой ткани.
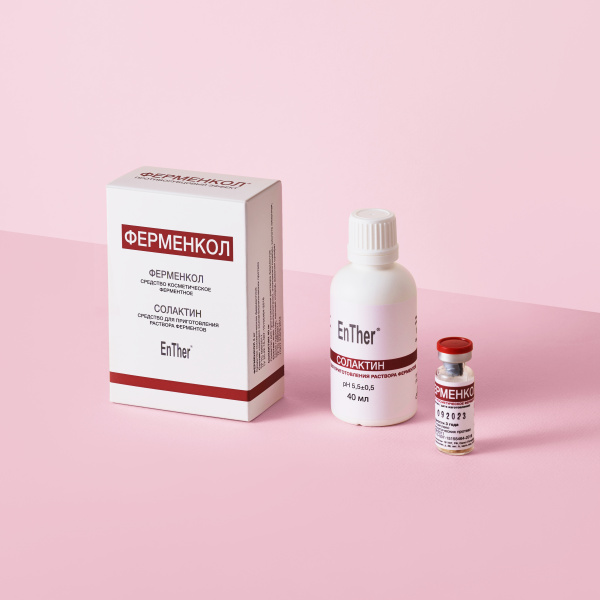
С целью профилактики стенозирования и рубцевания вновь сформированного меатуса мы применяли ферментный противорубцовый препарат Ферменкол — природный комплекс из 9 коллагенолити-ческих протеаз с молекулярной массой от 20 до 36 кДа, сырьем для которых служат пищеварительные органы морских гидробионтов.
Препарат обладает противорубцовым эффектом. В результате применения подобных препаратов происходит уменьшение рубца за счет разрушения в нем избыточного внеклеточного матрикса, прежде всего коллагена, а также нормализуются гидратация рубцовой ткани. Препарат в форме геля наносился ежедневно на область меатуса с 5-х суток (даже при наличии повязки попадание на рану безвредно) в течение трех недель. Эти же препараты мы применяли у 15-летнего подростка для улучшения косметических результатов.
Применение препарата Ферменкол позволило получить максимально выраженный положительный эффект у 17 из пролеченных пациентов (включая пациента 15 лет), удовлетворительный результат получен у 2 пациентов.
В заключение хотелось бы обратить внимание на то, что положительного эффекта при лечении гипоспадии можно достичь лишь при комплексном подходе к терапии. Особое внимание должно быть уделено не только оперативной технике, но и терапии в послеоперационном периоде, профилактике рубцеобразования и психосоциальной адаптации пациента.
Список литературы
- Галлямова Ю. А. Гипертрофические и келоидные рубцы // Лечащий врач. — 2009; 10: 20-23.
- Продеус П. П., Староверов О. В. Гипоспадия. — М., 2003 г. — 175 с.
- Angerpointer T. A. Hypospadias-genetics, epidemiology and other possible aetiological influences // Zeitshrift fur Kinderchirurgie. — 1984; 39 (2): 112-118.
- Devin C. J., Jr. Gonzalez-Serva L., Stecker J. F. et al. Utricular configuration inhypospadias and intersex // The Journal of urology. — 1980; 123 (3): 407-411.
- Duckett J. W. Hypospadias. In: Campbell’s Urology, 7th ed. Edited by P. C. Walsh, A. B. Retik, E. D. Vaughan, Jr. et al. Philadelphia: W. B. Saunders, 1998. — p. 2093.